智通财经网
近日,基因治疗CDMO宣布完成2亿元的B轮融资,由IDG资本和毅达资本联合领投,现有股东华盖资本、聚明创投、同创伟业等继续跟投加持。
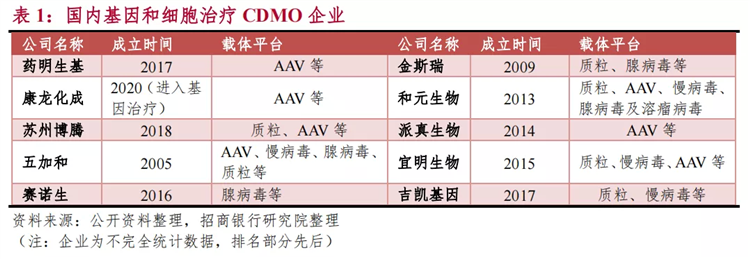
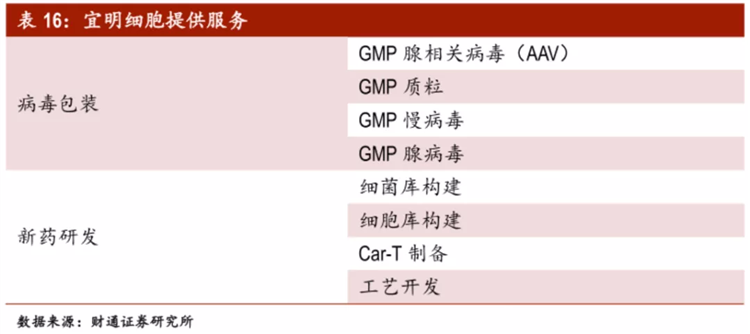
宜明细胞算是国内最早介入细胞及基因治疗CDMO赛道的企业之一,目前可面向客户提供GMP级别的质粒、慢病毒、腺病毒、AAV、CAR-T等病毒载体与基因药物开发服务,可满足客户从早期研发到商业化生产一站式需求,协助客户加速基因药物的研发、临床、上市。
9月16日,国内细胞疗法公司驯鹿医疗宣布完成1.08亿美元的C轮融资,加速公司管线的全球开发进程,本轮融资由鼎晖百孚领投,现有股东高瓴创投持续加投。
细胞疗法一直是高瓴近年来的重点投资方向,今年上半年高瓴旗下完成IPO的11家生物医药公司中有5家来自于细胞基因治疗赛道,包括科济医药、CenturyTherapeutics、LyellImmunopharma、TalarisTherapeutics、InstilBio等。
不仅如此,高瓴也在二级市场对细胞及基因治疗领域全面下注。以细胞与基因治疗CDMO细分为例,投资覆盖了药明康德(603259.SH,02359)、博腾生物、金斯瑞生物科技(蓬勃)(01548);在治疗药物方面,除CAR-T疗法外,还覆盖了TCR-T、TIL、NK细胞等多种细胞疗法。
一、细胞疗法:肿瘤患者的治愈之光
什么是细胞疗法?先从最常见的CAR-T疗法说起。
CAR-T细胞治疗是一种非常有前景的癌症治疗方法,目前被广泛应用于血液肿瘤中。
我们知道,T细胞是体内抗癌的主力,T细胞治疗一直被认为是治愈癌症最具前景的方向之一。而在免疫细胞自然杀伤肿瘤细胞的过程中,肿瘤细胞非常“聪明”,他通过发射信号、抑制T细胞等手段逃过免疫细胞的杀伤。
所以,T细胞需要适当的肿瘤特异性(精准识别肿瘤),有足够的数量,并且克服任何局部免疫抑制因素,才能有效。
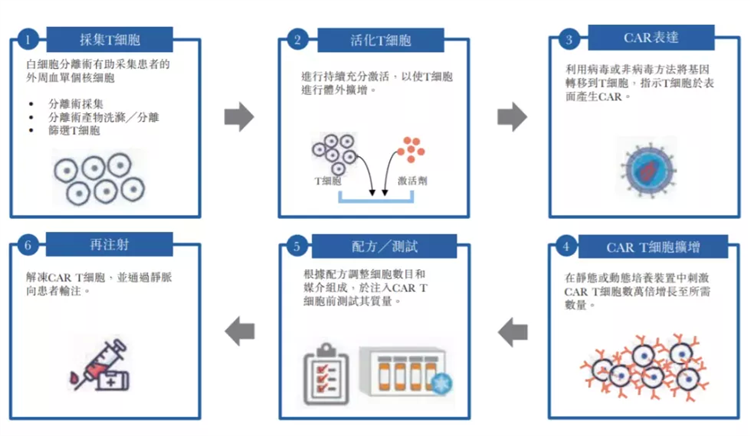
而CAR-T疗法应运而生(给T细胞装上导航),它从癌症病人身上分离免疫T细胞 → 利用基因工程技术,通过逆转录病毒和慢病毒载体、转座系统(如SB 转座系统)或直接将mRNA转导到T细胞内,使T细胞表面表达嵌和抗原受体(CAR),即成为CAR-T细胞,拥有识别癌细胞和增殖的作用 → 体外扩增CAR-T细胞,一般一个病人需要几十亿,乃至上百亿个CAR-T细胞(体型越大需要细胞越多)→ 把扩增好的CAR-T细胞输回病人体内,最后监控病人身体反应。
那么,T细胞可以改造,其他对肿瘤有杀伤能力的免疫细胞是否可以改造呢?
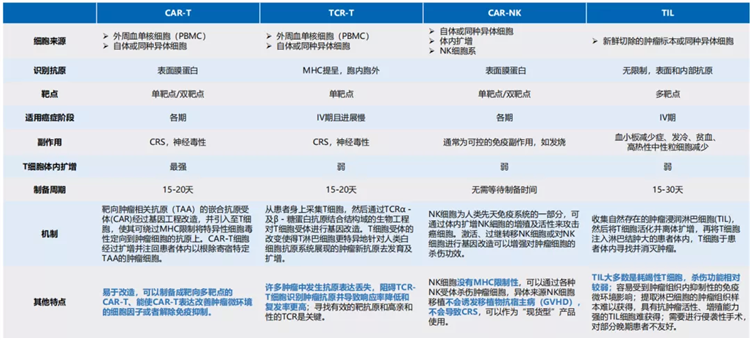
目前,经基因工程改造的细胞疗法,主要包括嵌合抗原受体T细胞(CAR-T)、T细胞受体T细胞(TCR)、嵌合抗原受体自然杀伤细胞(CAR-NK);而未经改造的细胞疗法包括调节性T细胞(Treg)、肿瘤浸润淋巴细胞(TIL)、细胞毒性T淋巴细胞(CTL)。
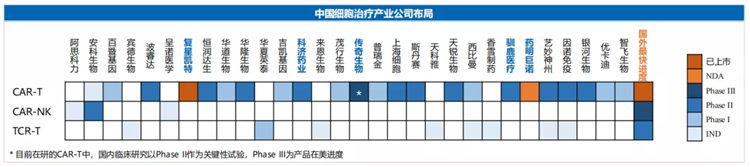
主要免疫细胞疗法概览
基于CAR-T疗法优异的机制和特点,使其成为免疫细胞疗法的主流疗法,而从国内细胞治疗公司的布局来看,目前大部分进入临床中后期的管线仍集中在CAR-T疗法。
说了那么多,最终落地还是要回到疗效上,细胞疗法能够使患者获益吗?两个典型的病例,其实很能说明问题。
Emily Whitehead,是全球首个接受CAR-T疗法的癌症患者。2010年,5岁的Emily被诊断出患有B细胞急性淋巴性白血病,在病情反复情况危殆的背景下接受了CAR-T细胞免疫疗法。令人惊喜的是,治疗效果非常好。今年5月,Emily迎来了她无癌生存九年的纪念日,这也使她成为这一疗法的代言人。
国内目前获批上市的细胞治疗产品有两款,分别是复星凯特的阿基仑赛注射液和药明巨诺的瑞基奥仑赛注射液。
今年8月,国内一名57岁患有弥漫大B淋巴瘤的女性患者,其遭遇复发且不适用于多种治疗方式的情况下,接受了复星凯特靶向CD19自体CAR-T产品治疗,也成为了阿基仑赛注射液国内的第一个患者。在接受了住院治疗后,检查后发现体内暂无癌细胞,症状获得了完全缓解,并于8月26日出院。
种种案例表明,这一疗法能够使肿瘤慢病化、甚至使肿瘤患者能够完全被治愈,这是目前大部分靶向治疗无法做到的,发展前景广阔。
二、投资痛点:商业化难题有待解决
尽管细胞疗法杀伤肿瘤细胞威力惊艳,但同样也有着商业化受限的烦恼,这成为市场投资者对细胞疗法望而却步的首要担忧点。
痛点一:面临着和PD-1相同的局面,靶点同质化,竞争肉眼可见的激烈
截至2020年6月30日,全球CAR-T治疗临床试验登记项目数量超600项,其中中国以357项临床试验位居全球首位,其中175项都是靶向CD19。
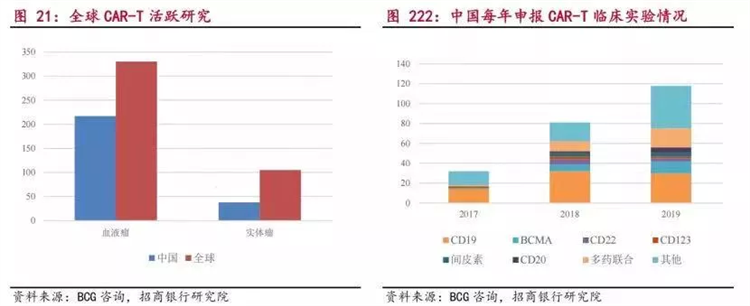
不敢想象,现在6款国产PD-1上市,价格就已经如此惨烈,即便这部分CD19 CAR-T仅有十分之一的管线成功获批,或许竞争只会更惨烈。未来降价,也是一定的。
痛点二:血液瘤向实体瘤进军,并不容易
数据显示,自1993年开始的所有细胞治疗试验中,只有一半是针对实体瘤(1203项中有596项)。
血液瘤和实体瘤患者的比例,却是1:9,这意味着目前主要的CAR-T在研管线仍在开发占比不到10%的癌症市场。
相比对血液肿瘤表现出的良好疗效,细胞疗法对实体瘤的治疗效果的突破迟迟未能打开局面。
这很大程度基于实体瘤的特性。
最困难的一点是理想靶抗原的鉴定。实体瘤表面存在异质抗原,这虽然提供了许多潜在的靶标,但许多实体瘤相关的抗原也在健康组织上表达,从而增加了脱靶不良事件的风险;其次是肿瘤微环境的限制,低氧、低PH、高压等都是阻止T细胞到达肿瘤细胞的物理屏障,造成了针对实体瘤的CAR-T产品疗效不佳。
痛点三:自体CAR-T制备周期局限性,制备成本居高不下,患者可及性受限
目前全球获批的CAR-T产品均为自体CAR-T,源头T细胞主要从患者自身体内提取,这就产生了几个问题。
一是CAR-T细胞的制备一般在2周~1个月时间,如果患者自身没有足够的T细胞或者T细胞不符合提取标准,那么很成问题。另外,这个等待时间,对于进展迅速的疾病来说,也是巨大的风险;
二是由于患者单批次制备的CAR-T细胞只能供患者一人使用,相当于是“定制”的销售模式,这也导致自体CAR-T疗法产品价格的居高不下,国内复星凯特和药明巨诺的产品均在百万元及以上。
三是CDMO生产端的技术工艺的不成熟、以及缺乏供商业化产品的大规模产能,也是令细胞疗法产品成本普遍高昂的重要原因。
阻碍CGT疗法发展的主要原因

三、解决问题的希望:有力量的前行者
虽然,国内CAR-T技术发展与欧美仍有差距,但这丝毫不妨碍我们的国度出现“有力量的”致力于推动细胞疗法产业链发展的前行者。
传奇生物(LEGN.US)是BCMA CAR-T产品的领跑者,公司的LCARB38M已经在今年3月完成了BLA申请提交,即将大部分处于临床I/II期,具备一定的进度优势。同时在疗效&安全性数据层面,对比巨诺、蓝鸟等已上市竞品,LCARB38M是潜在同类最佳产品。
科济药业(02171)是国内挑战实体瘤CAR-T产品的扛把子,手握Claudin18.2 CAR-T和GPC3 CAR-T两条治疗实体瘤的领先管线,尤其是前者在胃癌适应症展现出的优异疗效和未来的前景,使得公司股价表现摆脱了港股大多数18A一路下跌的命运。尽管后者GPC3 CAR-T的初步数据并不理想,但公司致力于升级迭代实体瘤CAR-T开发技术,已经迅速构建起了GPC3 CAR-T的升级版的管线。
行业已经充分认识到自体CAR-T的局限性,部分赛道玩家已提前抢先布局通货型CAR-T疗法,例如亘喜生物(GRCL.US)、邦耀生物、北恒生物、隆耀生物、克睿基因、茂行生物、森朗生物等。同时也不乏跨赛道探索细胞疗法联合其他药物的临床价值者,近日领先的小分子药开发商加科思战略投资细胞疗法公司Hebecell,布局iPSC-NK细胞疗法,展现出了独特的布局战略,并提出“现货型”iPSC-NK疗法有望降至10万元以下。
细胞治疗规模要扩大,生产成本必须降低,中国工厂显然是“最有希望的选手”,用放大镜CAR-T细胞制备价值链,最核心的成本端仍在于用到的科研设备、耗材和病毒载体的制备供应。
先从病毒载体放大生产技术迭代的角度看,目前悬浮细胞培养逐步成为病毒载体生产主流方式。国内细胞及基因治疗CDMO四大厂商药明生基、和元生物、博腾生物和金斯瑞蓬勃似乎都掌握了这类技术,未来或许都将迎来野蛮生长的时代。
而制备用到的自动化设备和耗材,普遍应用进口产品,未来国产替代的机会前景广阔,以自动化细胞分选设备为例,目前国内华雅再生医学、金斯瑞生物涉足,相较进口差距不小;耗材方面,磁珠、培养基是核心原料,培养基技术壁垒比磁珠相对低,目前义翘神州(301047.SZ)、奥浦迈、建顺、康晟生物等国产厂商逐渐展现竞争力。磁珠由于壁垒极高,国产目前仍然缺乏有竞争力的厂商。
总结:当实体瘤、成本问题迎刃而解之时,便迎来细胞疗法大显身手的时代。颠覆性的治疗药物,首先是让病人获益,而后,赚钱,是水到渠成的副产品。
届时,肿瘤成为慢病,可能已经实现。





发表评论 取消回复